Hele verden ser på muligheden for at genbruge medicin
Fremtidens medicin mod en lang række sygdomme findes måske i de lægemidler, der allerede er udviklet. Forskere fra blandt andet SDU leder efter lægemidler, som måske kan have effekt på helt andre sygdomme, end de er godkendt til behandling af.
I 1998 kom der et nyt lægemiddel på markedet, som for mange mænd åbnede døren til en ellers utilgængelig verden af fornøjelse. Det drejede sig naturligvis om Viagra, der var i stand til at sætte gang i sexlivet igen.
Men faktisk blev Viagra slet ikke udviklet med det formål, som det i dag bliver benyttet til. Viagra eller sildenafil, som det aktive stof i Viagra hedder, blev udviklet til behandling af hjertekramper.
De forskere, som undersøgte effekten af stoffet, fandt dog hurtigt ud af, at midlet havde en helt bestemt (bi)virkning hos de mandlige patienter.
Gavnlige effekter
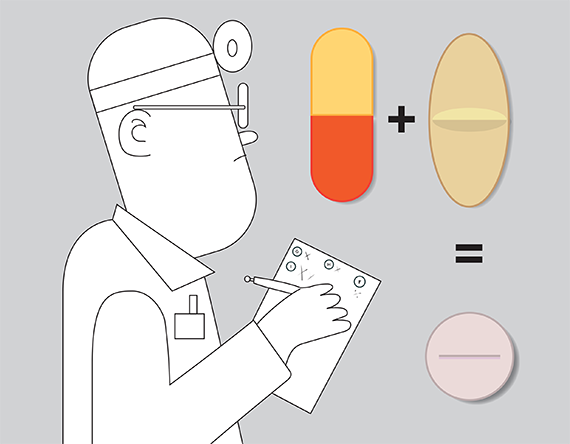
Viagra er bare ét eksempel på det, som vi på dansk kan betegne som genanvendelse af lægemidler. På engelsk hedder det drug repurposing. Det drejer sig om, at nogle lægemidler har effekter på sygdomme eller tilstande, som de slet ikke er udviklet til behandling af, men som forskere i et aha-øjeblik opdager.
Et andet eksempel på ovenstående er magnyler, som blev udviklet som smertestillende medicin. På et tidspunkt fandt læger ud af, at magnyler også kan modvirke udvikling af blodpropper, så i dag er lægemidlet også godkendt til forebyggende behandling af netop udvikling af blodpropper.
Værdi for patienterne
Det er indsatsen værd at lede efter lægemidler der kan have en effekt på helt andre sygdomme end dem, som de oprindeligt er udviklet til: Der er nemlig tale om allerede godkendte lægemidler, og derfor skal man ikke gennem årelange og ekstremt kostbare kliniske studier, før man kan tage dem i brug mod nye sygdomme. Det har indlysende værdi for patienterne.
Bare for få måneder siden blev diabetesmidlet dapagliflozin godkendt til behandling af kronisk nyresygdom, fordi forsøg havde vist, at behandling med dapagliflozin dramatisk kan reducere denne enorme patientgruppes risiko for at dø.
Rigtig mange lægemidler eller lægemiddelkandidater kan have en effekt på andre sygdomme end dem, som de er målrettet.
Og i disse år har forskere fra hele verden sat alle sejl ind på at finde ud af, om nogle af de allerede udviklede lægemidler kan benyttes til at behandle sygdomme, som vi i dag ikke har særlig gode behandlinger mod, eller som vi slet ikke kan behandle.
Forskere fra Syddansk Universitet er med i denne skattejagt efter genanvendelige lægemidler. Det drejer sig blandt andet om Jesper Hallas, der er professor ved Klinisk Farmakologi, Farmaci og Miljømedicin, professor Jan Baumbach fra Institut for Matematik og Datalogi og lektor Paolo Ceppi fra Institut for Biokemi og Molekylær Biologi.
Jesper Hallas og hans gruppe forsker faktisk ikke på nuværende tidspunkt i at finde lægemidler, der kan benyttes til behandling af andre sygdomme, end de er indiceret til. Men det kan han hurtigt komme til.
Jesper Hallas’ forskning er møntet på at trawle danske registre efter sammenhænge mellem brug af lægemidler og ukendte bivirkninger. Det kan som eksempel være, at et givent lægemiddel er forbundet med en overhyppighed i forhold til udvikling af blodpropper.
”Indtil videre har det altdominerende fokus dog været på at finde skadevirkninger af lægemidler, men data kan lige så godt bruges til det modsatte, nemlig at finde nyttevirkninger.
Men som Jesper Hallas siger, så kan han lige så godt kigge efter, om givne lægemidler utilsigtet er forbundet med en underhyppighed i forhold til risikoen for udvikling af blodpropper – altså at personer, som tager et middel mod eksempelvis hårtab eller hæmorider, langt sjældnere får en blodprop.
– Det kan gøre det værd i kliniske forsøg at undersøge, om det givne lægemiddel rent faktisk har en beskyttende effekt i forhold til udvikling af blodpropper, forklarer Jesper Hallas.
Verdens bedste registre
Han fortæller, at vi i Danmark råder over nogle af verdens bedste registre til på den måde at gå på jagt efter genanvendelige lægemidler. Det drejer sig i særdeleshed om Landspatientregisteret, der har registreret alle danskeres sygehuskontakter siden 1977, og Lægemiddelstyrelsens Receptregister, der har indsamlet data på alle udskrevne recepter i Danmark siden 1995.
Kun meget få lande har ligesom Danmark så komplette datasæt til at undersøge lægemidler for utilsigtede positive effekter.
Kombinerer man disse to registre, kan man både se, hvilken medicin folk har fået, og hvad det har betydet for forekomsten af forskellige sygdomme og tilstande.
– Det er oplagt at bruge registrene til at finde lægemidler mod sygdomme, som de i dag ikke bliver benyttet mod. Indtil videre har det altdominerende fokus dog været på at finde skadevirkninger af lægemidler, men data kan lige så godt bruges til det modsatte, nemlig at finde nyttevirkninger, siger Jesper Hallas.
Sammenhænge i sundhedsdata
Som et første skridt vil Jesper Hallas gerne kaste et bredt net i den enorme datamængde og se, hvad han fanger.
Det er dog lettere sagt end gjort, fordi medicinbrugere nu en gang er medicinbrugere, og det kan være svært at sammenligne deres sundhedstilstand med et bredt udsnit af befolkningens. Det findes der dog dataanalytiske løsninger på, og dem er Jesper Hallas i færd med at udvikle.
– Det er den videnskabelige udfordring, som vi prøver at løse. Men når vi har løst den i forhold til at finde bivirkninger, er det blot et spørgsmål om at dreje skruen en halv omgang, og så kan vi også bruge vores systemer til at finde lægemidler med positive effekter, som vi ikke havde regnet med, forklarer Jesper Hallas.
Mød forskeren
Jesper Hallas er professor ved Klinisk Farmakologi og Farmaci, Institut for Sundhedstjenesteforskning.
Jan Baumbach griber problemstillingen anderledes an end Jesper Hallas, selvom han også går på jagt med computeren og avancerede algoritmer.
I stedet udnytter han bioinformatik til at gennemtrawle den videnskabelige litteratur i spændfeltet mellem lægemidler, sygdomme og gener.
Jan Baumbach og hans forskergruppe integrerer data på en måde, så grupper af sammenhænge opstår. Det kan som eksempel være, at grupper af sygdomme har samme genetiske baggrund, eller at grupper af lægemidler har samme virkningsmekanisme.
”Vi kan bioinformatisk finde ud af, hvilke lægemidler der er målrettet de forskellige gener og mekanismer uden at være benyttet til at behandle den resulterede sygdom.
– Når man kan gruppere forskellige lægemiddelmål i klynger, har de målrettede sygdomme ofte mange sygdomsgener eller sygdomsmekanismer til fælles og lignende lægemidler til at behandle dem.
– Her kan det være relevant at se på, om lægemidler til behandling af én sygdom også kan benyttes til at behandle en anden sygdom, der har mange af de samme karakteristika, siger Jan Baumbach.
Man kan som eksempel forestille sig, at en sygdom er resultatet af en fejl i en signalvej i kroppen. Denne signalvej har flere forskellige involverede gener, hvor tingene kan gå galt og komme til udtryk i flere forskellige sygdomme.
Et middel mod flere kræftformer
Ét lægemiddel er måske udviklet til at rette op på fejl i signalvejen og dermed behandle sygdom A, mens det andet lægemiddel er udviklet til at rette op på fejl i signalvejen og dermed behandle sygdom B.
Her opstår der en mulighed for at kigge på, om de to forskellige lægemidler også kan have en effekt på de omvendte sygdomme. Det er disse sammenhænge, som Jan Baumbach finder.
– Vi kan bioinformatisk finde ud af, hvilke lægemidler der er målrettet de forskellige gener og mekanismer uden at være benyttet til at behandle den resulterede sygdom, siger han.
Jan Baumbach nævner som eksempel kræft. Nogle kræftformer kan have samme genetiske mutationsmønster som andre, og der kan det give mening at se på, om et middel til behandling af én kræftform også kan bruges til at behandle en anden.
Behandling af COVID-19
Et andet og meget nutidigt eksempel er remdesivir, der er godkendt til behandling af COVID-19.
Her kan det på samme måde som i førnævnte eksempel være interessant at se på, hvilke mekanismer i kroppen, som remdesivir er rettet mod, og lave en bred søgning i litteraturen efter andre lægemidler, som er rettet mod samme mekanisme.
Forskerne har faktisk allerede lavet den øvelse med COVID-19 og fundet en håndfuld kandidater, der er målrettet samme mekanisme i kroppen som remdesivir. Forskerne i Jan Baumbachs gruppe er netop nu i færd med at lave forsøg med disse lægemidler og lægemiddelkandidater for at se, om de kan kastes ind i kampen mod pandemien.
De kasserede kan måske bruges
– Ideen om at genbruge lægemidler i behandling af andre sygdomme er ikke ny, men forskere har gjort det ved at se på, om lægemidlerne har lignende strukturer. Her går vi meget dybere i data og ser på koblinger, som går ud over de strukturelle, forklarer Jan Baumbach.
Forskeren fortæller, at lægemiddelgiganten AstraZeneca blandt andre benytter tilgangen til at kigge på deres tusindvis af kasserede lægemiddelkandidater.
Mange af lægemiddelkandidaterne har måske haft succes i de tidlige kliniske forsøg med mennesker, men er så røget i svinget, da det har vist sig, at de kun har virket på en lille gruppe patienter.
– Men ved at gå bioinformatisk til værks kan de finde ud af, hvorfor lægemidlerne kun virkede i en særlig undergruppe af patienter, og så kan lægemidlerne få nyt liv igen. Man har måske et lægemiddel, som kun virker i 20 pct. af patienterne, men som til gengæld er 10 gange mere effektivt. Hvis man kan identificere den gruppe, som lægemidlet virker på, rummer det et stort potentiale. Det er årsagen til, at også de store virksomheder kigger på det, som vi laver, siger Jan Baumbach.
Mød forskeren
Jan Baumbach er professor og forskningsleder på Institut for Matematik og Datalogi og Münchens Tekniske Universitet.
En helt tredje måde at gå til problemstillingen på arbejder Paolo Ceppi med. Mens Jan Baumbach og Jesper Hallas kaster brede net i datasuppen, er Paolo Ceppi meget mere målrettet i forhold til de lægemidler og lægemiddelmål, som han kigger på.
Helt specifikt drejer det sig om lægemidler, der muligvis kan hæmme kræftmetastaser i at bliver dannet.
– Kræftpatienter bliver sjældent dræbt af deres første tumor, men i stedet af metastaser, som bliver dannet andre steder i kroppen. Derfor er vi meget interesserede i at finde lægemidler, der netop er målrettet de mekanismer i kroppens celler, som tillader, at kræft kan metastasere.
– Vi kender til de involverede signalveje og mekanismer, så vores mål er at kigge i de nuværende lægemidler og lægemiddelkandidater efter nogle stoffer, der er målrettet netop den mekanisme, forklarer Paolo Ceppi.
”Kan man holde kræfttumoren til bare det ene sted i kroppen, hvor den opstår, kan man redde rigtig mange menneskeliv på tværs af alle kræftformer.
For at gøre en lang historie kort, så udnytter kræftceller en helt specifik cellemekanisme, når de skal danne metastaser andre steder i kroppen.
Først skal de lave sig selv om til celler, der kan overleve i blodbanerne, mens de bliver transporteret rundt i kroppen, hvorefter de et nyt sted skal gennemgå den stik modsatte proces for at blive til en tumorcelle igen.
Denne mekanisme er faktisk ikke noget, som kræftcellerne selv har fundet på. Den ligger naturligt i vores gener og bliver benyttet i forbindelse med fosterudviklingen. Men kræftcellerne har fundet på en måde at genaktivere den og udnytte den til at lade sig transportere rundt i kroppen med det formål at danne metastaser.
Forhindre metastaser
En af disse mekanismer hedder Epithelial-mesenchymal transition (EMT), men der findes endnu ikke noget godkendt lægemiddel, som er målrettet EMT.
– Forhåbningen er, at man hos kræftpatienter kan blokere for EMT og på den måde forhindre udvikling af metastaser i forbindelse med kræftsygdom.
– Man kan ikke bruge et lægemiddel mod EMT til at fjerne metastaserne, når de først er dannet, men kan man holde kræfttumoren til bare det ene sted i kroppen, hvor den opstår, kan man redde rigtig mange menneskeliv på tværs af alle kræftformer, siger Paolo Ceppi.
20 mulige kandidater
Specifikt i sin forskning har Paolo Ceppi gennemgået den medicinske litteratur for at finde lægemidler, der blokerer for EMT uden at være godkendt som behandling til at forhindre dannelsen af metastaser.
Endnu mere konkret har forskeren kigget efter lægemidler, der blokerer for de metaboliske signalveje, der er relateret til EMT.
Sådanne lægemidler findes faktisk allerede, og Paolo Ceppi har i sin forskning fundet 20 molekyler, der ifølge forskeren muligvis kan genanvendes til at forebygge udvikling af metastaser. Blandt lægemidlerne er flere kræftmidler, men også midler mod depression, autisme, hjertekarsygdomme og alkoholisme.
– I vores studie har vi åbnet op for en diskussion af, hvordan man kan finde lægemidler, der er målrettet EMT. Data er allerede i litteraturen, men vi skal lave en systematisk søgning og efterfølgende undersøge, om disse lægemidler kan have den effekt, som vi efterspørger, siger Paolo Ceppi.
Illustrationer: Mikkel Larris, SDU
Mød forskeren
Paolo Ceppi er lektor og forskningsleder på Institut for Biokemi og Molekylær Biologi.